文章信息miR-100-5p-abundant exosomes derived from infrapatellar fat pad MSCs protect articular cartilage and ameliorate gait abnormalities via inhibition of mTOR in
osteoarthritis
Jiangyi Wu, Liang Kuang, Cheng Chen, Junjun Yang, Wei-Nan Zeng, Tao Li, Hao Chen, Shu Huang, Zhenlan Fu, Jiamiao Li, Renfeng Liu, Zhenhong Ni, Lin Chen, Liu
Yang
DOI: https://doi.org/10.1016/j.biomaterials.2019.03.022
Biomaterials (IF=8.806)
研究背景我们研究了髌下脂肪垫(IPFP)间充质干细胞(MSCs)的外泌体(MSCIPFP -Exos)在体外和体内对骨关节炎(OA)的作用和潜在机制。结果揭示一种治疗OA的新策略。
方法从关节病患者细胞分离外泌体,WB鉴定外泌体。对小鼠进行关节炎诱导,制备样品,进行组织学分析,免疫组化分析,蛋白印迹分析,绿色荧光蛋白分析,PCR定量分析,双荧光素酶报告基因测定,qPCR定量分析(wcgene biotech,Shanghai,上海启因生物 ),miRNA文库构建和测序,以及小鼠步态分析,最后对数据进行综合分析。
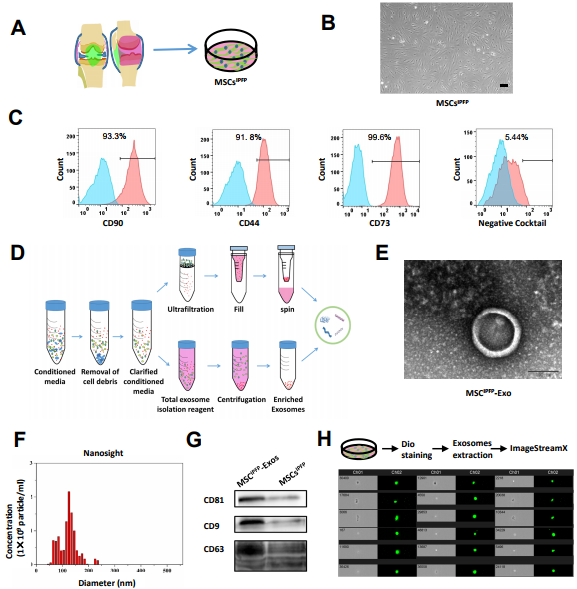
结果1.MSCsIPFP和MSCIPFP的分离与鉴定,结果说明人类髌下脂肪垫来源的MSCs可以产生大量的外泌体样小泡。
图1. (A)MSCsIPFP的分离流程图。 (B)MSCsIPFP显示出代表性的纺锤状形态。(C)MSCsIPFP 上细胞表面标志物的流式细胞术分析,蓝线代表同种型对照,红线代表测量的表面标志物。(D)MSCIPFP-Exos的分离示意图。(E)通过透射电子显微镜(TEM)观察到的MSCIPFP 8 -Exo的形态。(F)通过Nanosight测量的MSCsIPFP-Exos的粒度分布。(G)使用蛋白质印迹测量的MSCsIPFP-Exos和MSCsIPFP的表面标志物。(H)MSCsIPFP-Exos的流式细胞术成像。
2.MSCIPFP-外泌体能显著预防DMM小鼠软骨破坏,部分改善其步态异常。
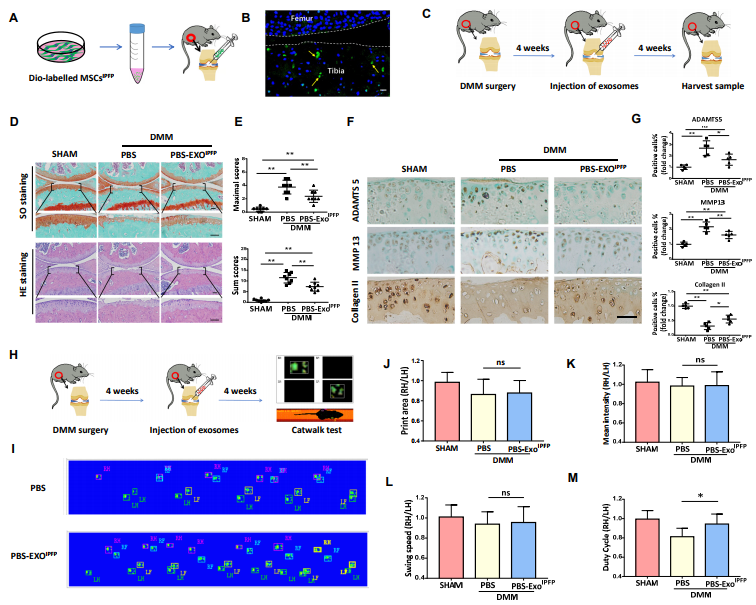
图2.(A)关节内注射方案。(B)代表膝关节中DiO标记的MSCsIPFP -Exos。黄色箭头表示MSCsIPFP -Exos,虚线表示关节表面。(C)关节内注射的设计。(D)Safranin O / Fast Green和H&E染色的膝关节部分。(E)用OARSI评分系统评估软骨破坏。(F)和(G)膝关节胫骨平台切片中胶原蛋白II,ADAMTS5和MMP13的免疫组织化学分析。(H)Catwalk测试的流程图。(I)Catwalk脚印的代表性信号图像。(J-M)组间比较的步态参数的水平变化。
3.MSCIPFP 449 -Exos抑制细胞凋亡并促进IL-1β诱导的软骨细胞合成代谢。
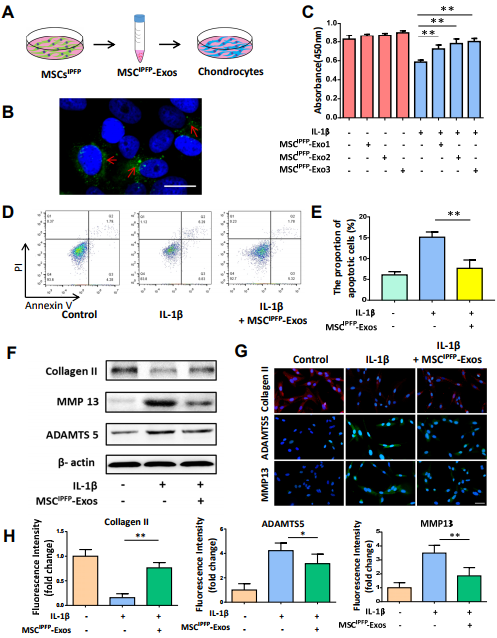
图3. (A)软骨细胞和MSCIPFP11-Exos共培养的模式。(B)由软骨细胞吸收的DiO标记的外泌体的代表性共聚焦显微照片。(C)MSCIPFP -Exos对软骨细胞活力的影响。(D)和(E)通过流式细胞术检测MSCIPFP -Exos对细胞凋亡的影响的结果并统计分析。(F)通过蛋白质印迹测量软骨细胞中胶原蛋白II,MMP13和ADAMTS5的蛋白质表达水平。(G)和(H)通过免疫荧光检测软骨细胞中的胶原蛋白II,ADAMTS5和MMP13表达及统计结果。
4. MSCIPFP -Exos通过抑制mTOR信号传导途径增强自噬水平
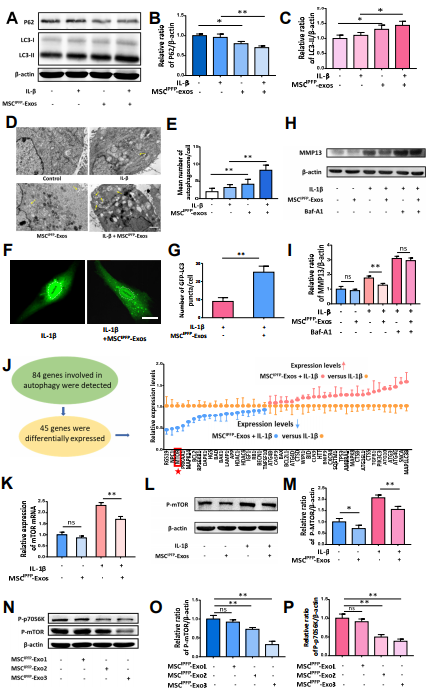
图4. (A)通过蛋白质印迹检测自噬相关蛋白表达。(B)和(C)三次独立实验的统计分析结果。(D)使用透射电子显微镜观察软骨细胞中的自噬体。(E)自噬体数量的定量分析。(F)使用荧光显微镜观察绿色荧光GFP-LC3斑点。(G)GFP-LC3斑点的统计分析。(H)通过蛋白质印迹检查MMP13的表达。(I)三次独立实验的统计分析结果。(J)通过PCR ARRAY检测软骨细胞中45个自噬相关基因的相对表达水平(wcgene biotech shanghai)。(K)通过qRT-PCR测定mTOR mRNA的表达。(L)和(M)通过蛋白质印迹测试P-mTOR的表达,并显示三个独立实验的统计分析。(N-P)通过蛋白质印迹检测P-mTOR和P-p70S6K的表达,并显示三个独立实验的统计学分析。
5. MSCIPFP-exos中的miR-100-5p介导mTOR的下调表达
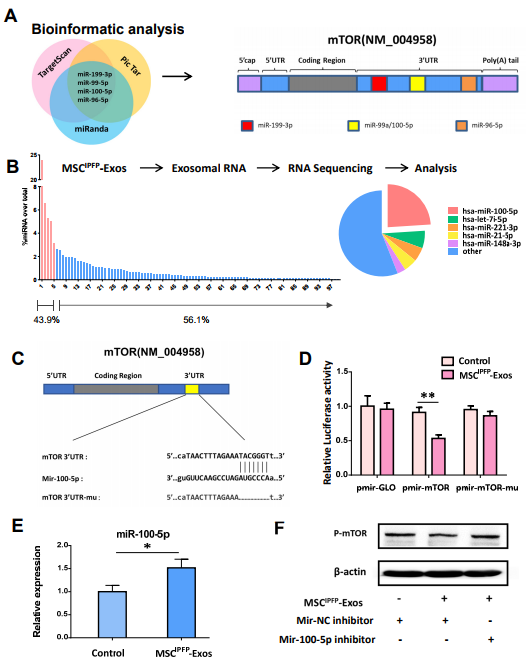
图5. (A)生物信息学分析预测mTOR和miR-100-5p之间的潜在结合序列。(B)miRNA在总miRNA读数中的相对比例。(C)表示mTOR mRNA的3'UTR中mir-100-5p的预测结合位点和突变型mTOR 3'UTR(mTOR 3'UTR-mu)的示意图。(D)使用双荧光素酶报告系统测定荧光素酶活性。(E)软骨细胞用软骨细胞MSCIPFP -Exos 培养24h,然后通过qRT-PCR检测mir-100-5p的相对表达。(F)通过蛋白质印迹检查P-mTOR的蛋白质水平。
6. 关节内注射antagomir-100-5p可破坏MSCIPFP-Exos对DMM模型中受损软骨的治疗作用
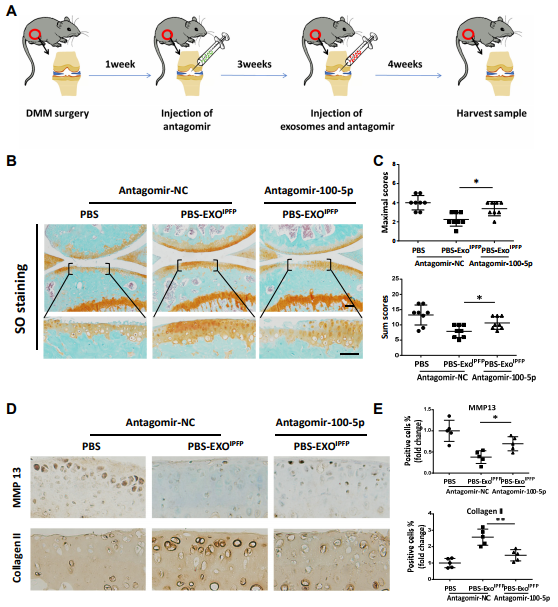
图6(A)显示关节内注射时间的流程图。(B)小鼠膝关节的染色。(C)DMM小鼠膝关节的OARSI评分。(D)和(E)膝关节胫骨平台切片中胶原蛋白II和MMP13的免疫组织化学分析。
7.在DMM模型中Antagomir-100-5p部分逆转MSCIPFP-Exos调节的mTOR信号。
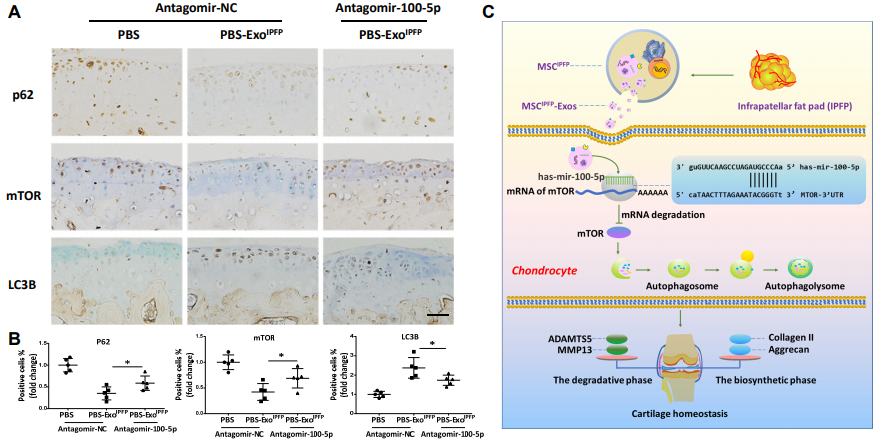
图7. (A)和(B)膝关节胫骨平台切片中P62,LC3B和mTOR的免疫组织化学分析。(C)软骨保护中MSCIPFP -Exos的潜在机制。
结果总结本研究表明,MSCIPFP外泌体可以通过抑制软骨细胞凋亡,平衡合成代谢和分解代谢过程来保护软骨免受损伤,并改善DMM诱导的OA小鼠的步态模式。 该机制可能与miR100-5p介导的mTOR-自噬途径的抑制有关。 由于临床关节镜手术从OA患者获取人IPFP相对方便可行,我们的研究结果可能为使用MSCIPFP -Exos治疗骨性关节炎提供新的潜在治疗策略。