货号:WC-MRNA0285-H
产品介绍:
PD-1是T细胞激活后T细胞上表达的关键共抑制受体之一。在与其配体(主要是PD-L1)结合后,PD-1被激活,并在T细胞受体(TCR)和CD28信号传导附近重新募集磷酸酶SHP-2。该事件导致TCR和CD28途径中关键分子的去磷酸化和衰减,导致抑制T细胞增殖、活化、细胞因子产生、改变代谢和细胞毒性T淋巴细胞(CTL)杀伤功能,并最终导致活化T细胞死亡。机体进化出共同抑制途径,控制T细胞反应的幅度和持续时间,以限制组织损伤并维持自身耐受性。然而,肿瘤细胞通过PD-L1的过度表达劫持这些抑制途径以逃避宿主免疫监视。这为免疫检查点抑制剂在肿瘤学中的临床应用提供了科学依据。PD-L1在肿瘤微环境(TME)中异常高表达可归因于多种致癌信号的“初级”激活和炎症因子(如IFN-γ)的“次级”诱导。临床上,针对PD-1/PD-L1的抗体可使TME中“耗尽”的T细胞恢复活力,并在大量肿瘤(如黑色素瘤、淋巴瘤和错配修复缺陷性肿瘤)中显示出显著的客观反应和持久缓解,毒性特征可接受。然而,大多数患者仍然对抗PD-1/PD-L1治疗不耐受。识别预测性生物标志物并设计合理的基于PD-1的联合治疗成为癌症免疫治疗的重点。PD-L1表达、细胞毒性T淋巴细胞浸润和肿瘤突变负荷(TMB)通常被认为是影响PD-1/PD-L1阻断效果的最重要因素
WCGENE®PCRArrayPlate操作简单。只需要将cDNA与qPCRmix混匀,然后加入每个孔里,上机检测,即可通过分析qPCR结果找到样品中差异表达的基因。具有重复性高,灵敏性强,操作便捷等特点。为实验研究者节省了预实验、引物验证、文献选择基因等繁琐的过程,可以直接了解不同信号通路或疾病中关键基因的差异情况。
产品内容
品 名:
PD-1 and PD-L1 Signaling pathway PCR Array plate
种 属:
Human
货 号:
WC-MRNA0285-H
规 格:
96孔板
品 牌:
Wcgene® biotech
产 品:
96孔引物预置板,封板膜,说明书
储 存:
-20℃
有效期:
六个月
生产日期:
见外包装
使用限制:
本产品仅供科研使用,不应用于诊断、预防和治疗疾病。
基因列表
Human
1
2
3
4
5
6
7
8
9
10
11
12
A
AKT1
CD274
CSNK2A1
HRAS
JAK2
MAP2K6
MTOR
NFKBIE
PIK3R3
PTEN
STAT1
TRAF6
B
AKT2
CD28
CSNK2A2
IFNG
JUN
MAP3K3
MYD88
NRAS
PLCG1
PTPN11
STAT3
ZAP70
C
AKT3
CD3D
CSNK2B
IFNGR1
KRAS
MAPK1
NFATC1
PDCD1
PPP3CA
PTPN6
TICAM1
NFKBIB
D
ALK
CD3E
EGF
IFNGR2
LAT
MAPK11
NFATC2
PIK3CA
PPP3CB
RAF1
TICAM2
PIK3R2
E
BATF
CD3G
EGFR
IKBKB
LCK
MAPK12
NFATC3
PIK3CB
PPP3CC
RASGRP1
TIRAP
PRKCQ
F
BATF2
CD4
EML4
IKBKG
MAP2K1
MAPK13
NFKB1
PIK3CD
PPP3R1
RELA
TLR2
RPS6KB2
G
BATF3
CHUK
FOS
IL6
MAP2K2
MAPK14
NFKBIA
PIK3R1
PPP3R2
RPS6KB1
TLR4
TLR9
H
CD247
CSK
HIF1A
JAK1
MAP2K3
MAPK3
ACTB
GAPDH
HPRT1
18S
NTC
NTC
PD-1和PD-L1信号通路图:
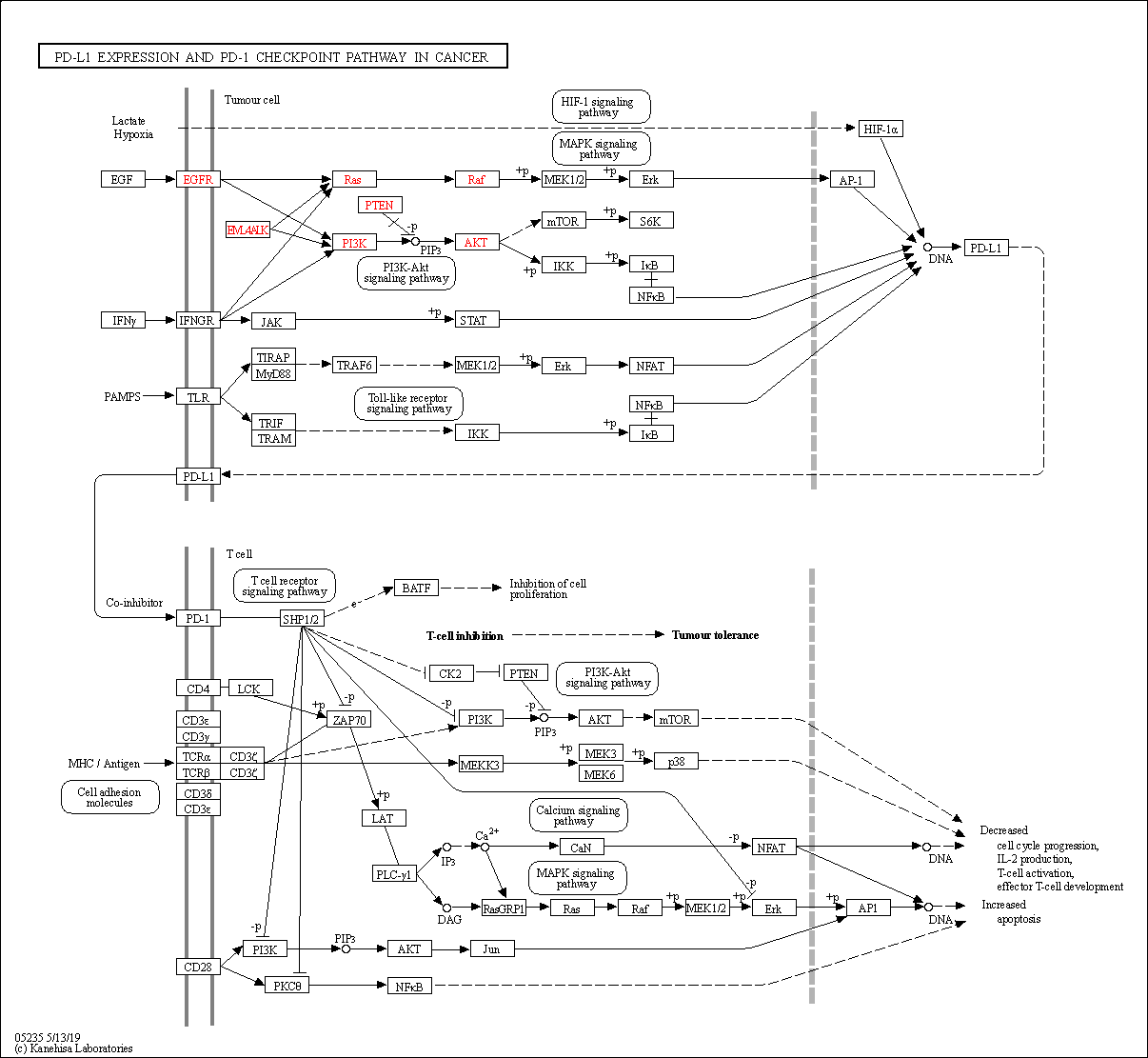
图片来源于:https://www.kegg.jp/pathway/map05235
检测原理
实时定量荧光PCR即通过实时检测 PCR 每一个循环扩增产物相对应的荧光信号,来实现对起始模板进行定量及定性的分析,本实验采取荧光染料法,在 PCR 反应体系中,加入荧光染料,荧光染料特异性地掺入 DNA 双链后,发射荧光信号,而不掺入链中的染料分子不会发射任何荧光信号,从而保证荧光信号的增加与 PCR 产物的增加完全同步。
产品介绍
PCR Array也被称作基因功能分类芯片或PCR阵列,它以96孔板或者384孔为载体,将目的基因引物固定在孔里,可同时定量、定性检测多个基因,具有高灵敏性和高特异性,是分析信号通路或某生物学功能相关基因表达状态的首选工具。
WCGENE® PCR ARRAY Plate含90个目的基因和4个内参基因,只需要将cDNA与qPCR MIX混匀,然后加入每个孔里,即可通过分析qPCR结果找到样品中差异表达的基因。具有重复性高,灵敏性强,操作便捷等特点。为实验研究者节省了预实验、引物验证、文献选择基因等繁琐的过程,可以直接了解不同信号通路或疾病中关键基因的差异情况。
流程图

操作步骤
1. 将样品提取RNA,并逆转成cDNA,样品要求如下(建议范围):
RNA:
无明显降解,A260/A280比值应为1.8-2.0
cDNA:
严格按照所用试剂盒说明书操作
cDNA原液预实验内参范围:
ACTB或GAPDH的CT值:细胞15左右;组织18左右
*推荐使用Wcgene® mRNA cDNA kit合成cDNA
2. 板子使用前离心,2000r离心20 秒,离心结束后将封板膜小心撕掉。
3. 按照表a配制cDNA和mix混合液920μl,将配好的混合液混匀后按每个孔9μl量加板,加完后用透明封板膜封板,2000r离心20 秒,上机检测。
表a. cDNA和mix混合液配方表
组成成分
96孔
(搭配96孔板,每孔9 μl)
Wcgene® mRNA qPCR mix (2×)
510 μl
cDNA sample
100 μl
无RNA酶ddH2O
290 μl
ROX Reference Dye(50×)
20 μl
总体积
920 μl
4. 反应体系设置10μl,程序设置如表b所示
表b. PCR反应条件(WCGENE ® mRNA qPCR mix试剂盒为例)
循环
温度
时间
预变性
1
95℃
30 sec
变性
40
95℃
5 sec
退火延伸
40
60℃
30 sec
熔解曲线分析
5. 上机开始Real Time PCR反应
6. 结果导出,数据分析
芯片与适用的Real Time PCR仪(本品仅适用于订单所写机器型号)
Plate format
Instrument provider
qPCR instrument model
A (96 well)
Roche Applied Science
LC480
Bio-rad
CFX96
B (96 well)
Applied Biosystems
7500, 7900HT, ViiA 7
C (96 well)
Applied Biosystems
7500 Fast System, 7900HT Fast System, StepOnePlus, ViiA 7 Fast System
参考文献
Zhu J J, Liu Y F, Zhang Y P, et al. VAMP3 and SNAP23 mediate the disturbed flow-induced endothelial microRNA secretion and smooth muscle hyperplasia[J]. Proceedings of the National Academy of Sciences, 2017, 114(31): 8271-8276.
Siqing Yue, Jie Yu, Yuan Kong, Haofeng Chen, Manfei Mao, Chenyang Ji, Shuai Shao, Jianqiang Zhu, Jinping Gu, Meirong Zhao,Metabolomic modulations of HepG2 cells exposed to bisphenol analogues,Environment International,Volume 129,2019,Pages 59-67,ISSN 0160-4120,
Zhao Y, Wang J, Xu C, et al. HEG1 indicates poor prognosis and promotes hepatocellular carcinoma invasion, metastasis, and EMT by activating Wnt/β-catenin signaling[J]. Clinical Science, 2019, 133(14): 1645-1662.
| 购买人 | 会员级别 | 数量 | 属性 | 购买时间 |
|---|





