M)通过蛋白质印迹测试P-mTOR的表达,并显示三个独立实验的统计分析。(N-P)通过蛋白质印迹检测P-mTOR和P-p70S6K的表达,并显示三个独立实验的统计学分析。
5. MSCIPFP-exos中的miR-100-5p介导mTOR的下调表达
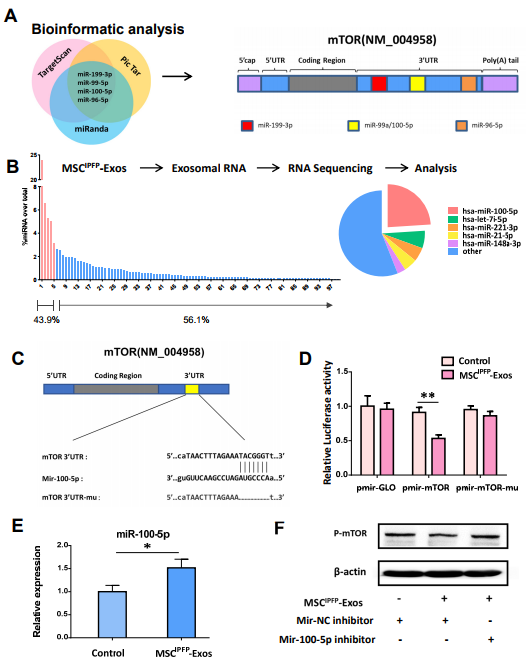
图5. (A)生物信息学分析预测mTOR和miR-100-5p之间的潜在结合序列。(B)miRNA在总miRNA读数中的相对比例。(C)表示mTOR mRNA的3'UTR中mir-100-5p的预测结合位点和突变型mTOR 3'UTR(mTOR 3'UTR-mu)的示意图。(D)使用双荧光素酶报告系统测定荧光素酶活性。(E)软骨细胞用软骨细胞MSCIPFP -Exos 培养24h,然后通过qRT-PCR检测mir-100-5p的相对表达。(F)通过蛋白质印迹检查P-mTOR的蛋白质水平。
6. 关节内注射antagomir-100-5p可破坏MSCIPFP-Exos对DMM模型中受损软骨的治疗作用
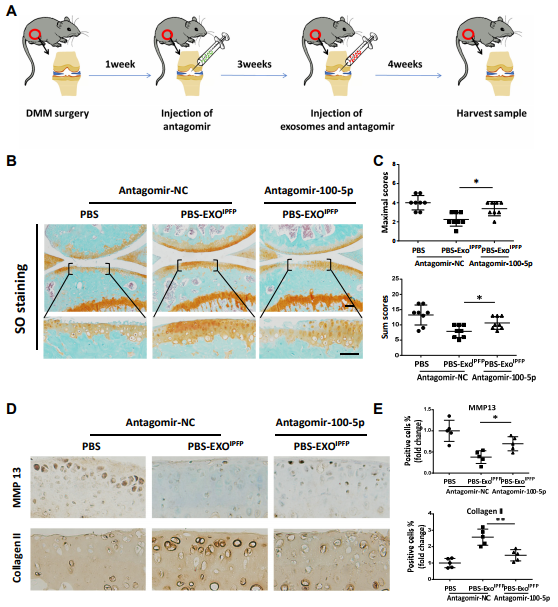
图6(A)显示关节内注射时间的流程图。(B)小鼠膝关节的染色。(C)DMM小鼠膝关节的OARSI评分。(D)和(E)膝关节胫骨平台切片中胶原蛋白II和MMP13的免疫组织化学分析。
7.在DMM模型中Antagomir-100-5p部分逆转MSCIPFP-Exos调节的mTOR信号。
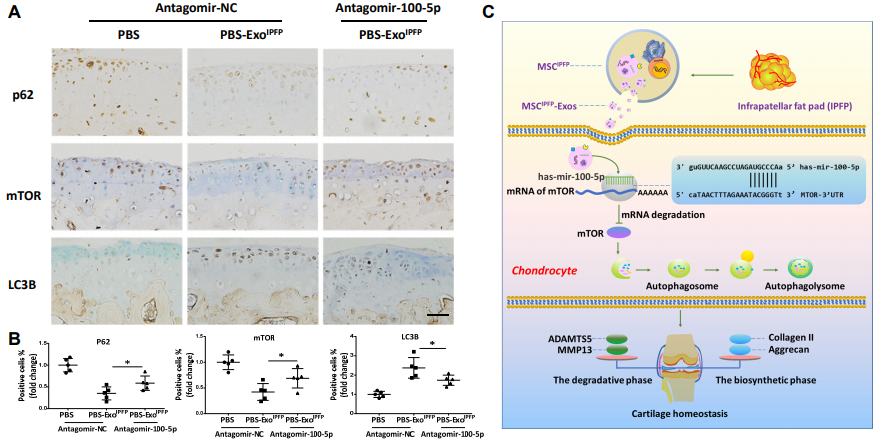
图7. (A)和(B)膝关节胫骨平台切片中P62,LC3B和mTOR的免疫组织化学分析。(C)软骨保护中MSCIPFP -Exos的潜在机制。
结果总结本研究表明,MSCIPFP外泌体可以通过抑制软骨细胞凋亡,平衡合成代谢和分解代谢过程来保护软骨免受损伤,并改善DMM诱导的OA小鼠的步态模式。 该机制可能与miR100-5p介导的mTOR-自噬途径的抑制有关。 由于临床关节镜手术从OA患者获取人IPFP相对方便可行,我们的研究结果可能为使用MSCIPFP -Exos治疗骨性关节炎提供新的潜在治疗策略。


